Die Helicobacter pylori-Infektion ist eine bakterielle Erkrankung des Magens.
Die Helicobacter pylori-Infektion kann symptomatisch und asymptomatisch verlaufen kann. Für die Entdeckung des gleichnamigen Bakteriums im Jahre 1983 erhielten Marshall und Warren 2005 den Nobelpreis.
Definition
Helicobacter pylori ist ein gramnegatives Stäbchenbakterium mit lophotricher Begeißelung, welches den menschlichen Magen besiedeln und eine Gastritis auslösen kann. In diesem Falle wird von einer Infektion und von einer Erkrankung gesprochen, unabhängig davon, ob Symptome auftreten oder nicht. Die Helicobacter pylori-Infektion steht mit weiteren Folgeerkrankungen, wie der peptischen Ulkuskrankheit, dem Adenokarzinom des Magens oder dem Marginalzonen-B-Zell-Lymphom des MALT (mucose-associated lymphoid tissue), in Zusammenhang.
Epidemiologie
Die globale Prävalenz der Helicobacter pylori-Infektion (H. pylori) zeigt starke Schwankungen zwischen verschiedenen Regionen. Am höchsten ist sie in Afrika und beträgt 70,1%, während ein Minimalwert von 24,4% in Ozeanien vorliegt. Innerhalb Europas ist die Prävalenz variabel mit Höchstwerten von 86,4% in Portugal und Minimalwerten von 18,9% in der Schweiz. H. pylori gilt als wesentlicher Risikofaktor für die Entstehung einer Ulkuserkrankung sowie Magenkarzinomen. Je nach Gebiet sind etwa 60% der Ulzera ätiologisch auf die H. pylori-Infektion zurückzuführen, während in ungefähr 90% der Fälle die H.-pylori-Infektion als Ursache des Magenkarzinoms gilt.
Ursachen
Die genaue Übertragungsweise der H. pylori-Infektion ist noch ungeklärt. Als wesentlicher Faktor der Infektionstransmission gilt die Infizierung im familiären Kreis. Mögliche Übertragungswege sind die oral-orale, gastral-orale sowie fäkal-orale Verbreitung oder deren Kombination.
Pathogenese
H. pylori besiedelt die Mukosa des Magens und besitzt die Fähigkeit, Urease zu bilden. Hierbei handelt es sich um ein Enzym, welches Harnstoff zu Kohlenstoffdioxid und Ammoniak spaltet. Ammoniak sorgt in unmittelbarer Umgebung des Bakteriums für einen Anstieg des pH-Werts, wodurch dieses vor Salzsäure geschützt ist. Weitere von H. pylori sezernierte Enzyme wie Protease, Lipase und Phospholipase A2 führen zu einer Hemmung der Produktion von Mukus, welcher einen Schutz des Epithels gegenüber dem sauren Magen-Milieu darstellt. Durch die damit einhergehende Desintegration der Mukosaschicht kann das Bakterium spezifisch an Magenepithelzellen binden.
Diese Bindung stellt für H. pylori einen mechanischen Schutz gegenüber der Magenmotorik dar, zudem löst sie eine Immunantwort der Wirtszellen aus. Dies resutliert in einer weiteren Schädigung der Magenmukosa, da zytotoxische T-Zellen durch die Erkennung von antigen-wirksamen Peptiden an der Oberfläche von Epithelzellen Apoptose induzieren können.
Die auf diesen Wegen stattfindende dauerhafte Störung und Entzündung der Magenschleimhaut wird als chronische Gastritis bezeichnet, welche bei den meisten Personen asymptomatisch verläuft. In manchen Fällen kann die veränderte gastrische Sekretion im Zusammenspiel mit Gewebeverletzungen zur Entwicklung der peptischen Ulkuskrankheit führen. Weiterhin kann sich im Verlauf eine Zell-Atrophie, interstitielle Metaplasie und schließlich ein Magenkarzinom ausbilden.
Das CagA-Gen (cytotoxin-associated gene A), welches für ein gleichnamiges Protein kodiert, kann beispielsweise bei fast allen in Ostasien isolierten H. pylori-Stämmen nachgewiesen werden, während es bei ungefähr 30-40% der in Westeuropa isolierten Stämme abwesend ist. Das Protein bewirkt eine verbesserte Durchlässigkeit des Epitheliums für Harnstoff, sodass der bakteriellen Urease mehr Substrat zur Verfügung steht und die Infektiosität des Pathogens erhöht ist. CagA-positiven Stämmen wird dadurch ein erhöhtes Risiko zur Entwicklung peptischer Ulzera zugeschrieben. Des Weiteren werden CagA-positive Stämme schon seit Jahren mit einem erhöhten Risiko von Präkanzerosen sowie Magenkarzinomen assoziiert. Neuere Studien zeigten, dass das CagA-Protein Tumorsuppressor-Gene inhibiert.
Symptome
Die klinische Manifestation einer H. pylori-Infektion zeigt sich sehr variabel. Die meisten Betroffenen sind asymptomatisch, während beim symptomatischen Verlauf unspezifische leichte gastrointestinale Beschwerden bis hin zur akuten Blutung und Perforation als Ulkus-Komplikation auftreten können. Da die H. pylori-Infektion zu einer Magenschleimhautentzündung führt, manifestieren sich die häufigsten Symptome im Rahmen einer akuten Gastritis. Hierfür existiert kein typisches Beschwerdebild. Mögliche Symptome sind:
- Völlegefühl
- Sodbrennen
- Schmerzen im Oberbrauch
- Übelkeit
- Erbrechen
Bei der chronischen Gastritis können diese Beschwerden in geringfügiger Form auftreten oder abwesend sein. Ausschließlich anhand der klinischen Symptomatik ist es jedoch nicht möglich zwischen einer H. pylori-positiven und einer H. pylori-negativen Gastritis zu unterscheiden.
Diagnostik
Es wird empfohlen nur Patienten und Patientinnen auf das Vorliegen von H. pylori zu testen, bei denen ein positiver Test die Therapie beeinflussen würde. Indikationen zur Testung stellen dar:
- In der Vorgeschichte bekanntes oder neu nachgewiesenes Ulkus ventrikuli oder duodeni
- Gastrales MALT-Lymphom
- Dyspepsie
- ITP (idiopathische thrombozytopenische Purpura)
- IgA Vaskulitis
- Ungeklärte oder refraktäre Eisenmangelanämie
- Erhöhtes Magenkarzinomrisiko
- Geplante Dauertherapie mit niedrig dosiertem Acetylsalicylsäure (ASS), nicht steroidale Antirheumatika (NSAR) und/ oder Antikoagulation
- bei Patienten mit erhöhtem Risiko für eine Ulkus-Krankheit
- Entwicklung einer gastroduodenalen Blutung unter Einnahme von NSAR, ASS, Antikoagulanzien und/ oder P2Y12-Inhibitoren
Generell gilt die Diagnose einer H. pylori-Infektion als zuverlässig, wenn zwei positive Ergebnisse mit unterschiedlichen Testverfahren vorliegen, wobei dies im praktischen Alltag selten stattfindet. Bei folgenden Konstellationen ist ein zweites Testverfahren nicht notwendig:
- Ein histologischer Nachweis von H. pylori liegt in Kombination mit einer chronisch aktiven Gastritis vor
- Es liegt ein Ulkus duodeni sowie ein positives Testergebnis auf H. pylori bei hoher H. pylori-Prävalenz vor
Unter diesen Umständen gilt eine H. pylori-Infektion als gesichert. Zu beachten ist, dass eine negative Kultur die H. pylori-Infektion nicht ausschließt und weitere Diagnostik erfordert, wenn ein klinischer Verdacht weiterhin besteht.
Urease-Atemtest: Urease spaltet Harnstoff in Kohlenstoffdioxid und Ammoniak. Zu falsch-positiven Befunden kann eine bakterielle Überwucherung des Magens führen, da es neben dem H. pylori weitere Bakterien gibt, die Harnstoff spalten. Vorbehandlungen mit Protonenpumpeninhibotoren (PPI), vor kurzer Zeit erfolgte Antibiotika-Therapien und Blutungen des oberen Gastrointestinal-Trakts können falsch negative Ergebnisse vortäuschen.
Antigen-Schnelltests: Weitere nicht-invasive Testverfahren sind Stuhlantigen-Schnelltests, die auf monoklonalen Antikörpern basieren sowie IgG-Antikörpertests zum Nachweis von Antikörpern im Serum.
Invasive Verfahren: Die invasiven Testungen beruhen auf einem endoskopischen Verfahren mit Biopsie-Entnahme. Die Gewebeproben werden im Anschluss histologisch untersucht oder einem Urease-Schnelltest unterzogen. Die Histologie stellt die aussagekräftigste Methode dar, da über das histologische Entzündungsbild einer chronischen Gastritis in Kombination mit der Bakterienmorphologie eine H. pylori-Infektion sicher nachgewiesen werden kann und ferner Aussagen zur Therapierelevanz, Prognose und dem Risiko der Entstehung eines Karzinoms getätigt werden können. Liegen Symptome vor, die auf eine Schädigung im oberen Gastrointestinaltrakt deuten, ist eine endoskopische Testung mit Biopsie-Entnahme begründet. Des Weiteren wird die histologische Diagnostik empfohlen, wenn in der Vorgeschichte eine Magenteilresektion bekannt ist. Unter diesen Umständen ist die Fläche der Magenschleimhaut vermindert, sodass die Sensitivität nicht invasiver Tests beeinträchtigt ist. Auch bei PPI-Therapie wird die Histologie bevorzugt, da in diesem Fall die Bakteriendichte reduziert ist und die Sensitivität nicht-invasiver Tests beeinträchtigt ist. In diesem Rahmen sollte vor der Diagnostik, sofern klinisch vertretbar, die PPI-Therapie für zwei Wochen pausiert werden und in den vorangegangenen vier Wochen keine Antibiotikatherapie erfolgen.
Differenzialdiagnostik
Neben der H.-pylori-Gastritis gibt es viele weitere Arten der Gastritis mit abweichender Ätiologie, beispielsweise die chemisch-induzierte/ reaktive Gastritis oder die Autoimmungastritis. Da die Symptomatik bei einer (H. pylori)-Gastritis unspezifisch ist, ist es wichtig, differentialdiagnostisch weitere Erkrankungen des Gastrointestinaltrakts in Betracht zu ziehen:
- Morbus Crohn
- GERD (Gastroesophageal reflux disease)
- Gastroduodenaler Ulkus: Neben einer H. pylori-Infektion können weitere Faktoren eine Ulkus-Entstehung auslösen, beispielsweise Alkohol- und Nikotinkonsum, NSAR-Einnahme, Stress, genetische Prädisposition, Zollinger-Ellison-Syndrom, Gastrisches Adenokarzinom
Welche Therapie hilft bei Helicobacter pylori-Infektion?
Ziel der Therapie einer H. pylori-Infektion ist die Eradikation des Erregers. Diese erfolgt medikamentös.
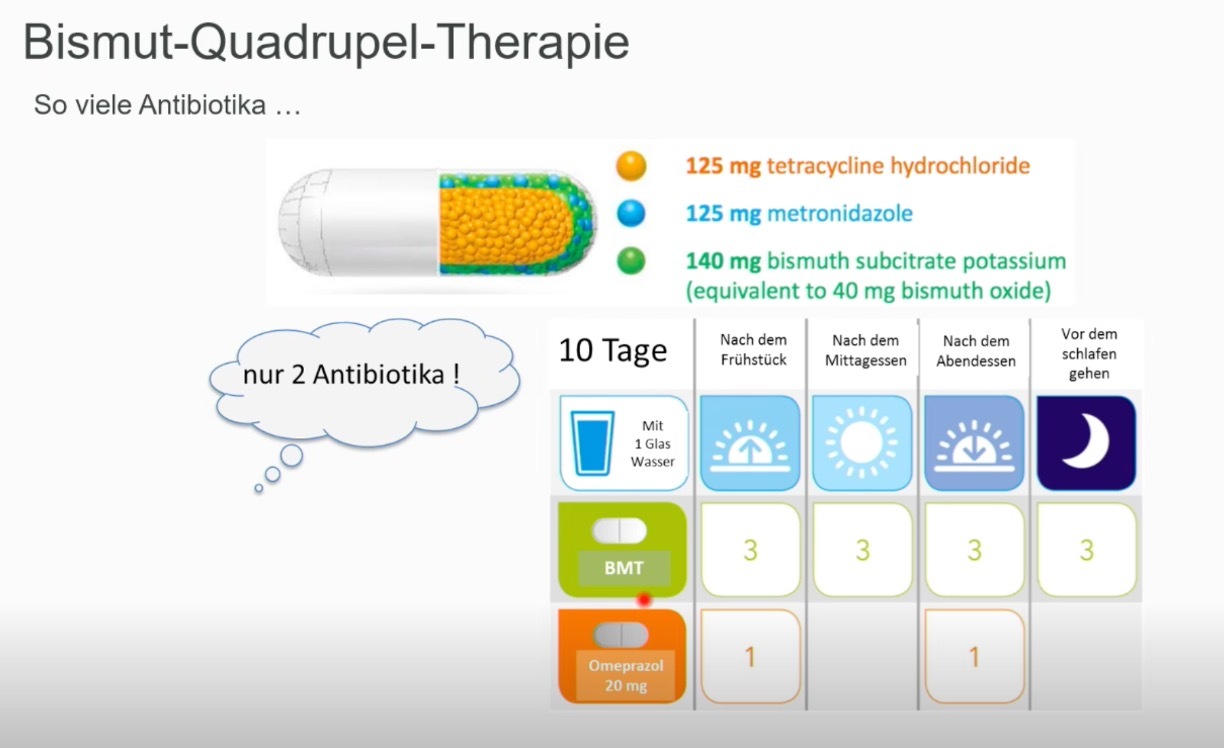
Als Erst-Linientherapie wird eine Bismuthaltige Quadrupeltherapie für zehn Tage empfohlen, wobei eine Eradikationsrate von >90% angestrebt wird. Diese Quadrupeltherapie besteht aus Protonenpumpenhemmern, Bismut, Tetracyclin und Metronidazol (Pylera als Kombinationspräparat).
Wenn die Erstlinientherapie erfolglos bleibt, wird eine Resistenztestung empfohlen. Hierbei sollte insbesondere eine mögliche Resistenz gegenüber Clarithromycin untersucht werden, da dieses Schlüsselbestandteil der Standard-Triple-Therapie ist, welche als Zweit-Linientherapie für 14 Tage empfohlen wird. Sie besteht aus Protonenpumpenhemmer, Clarithromycin und Amoxicillin.
Prätherapeutische Resistenzen gegen Amoxicillin sind sehr selten. Besteht eine Penicillin-Allergie, kann Amoxicillin durch Metronidazol ersetzt werden. Ebenfalls kann eine Fluorchinolon-haltige Triple-Therapie erfolgen. Versagt auch die Zweit-Linientherapie, erfolgen weitere Therapieversuche ausschließlich durch Spezialisten und Spezialistinnen nach Reserveschemata.
Zur Verbesserung der Therapiewirksamkeit trägt der Rauchstopp bei. Eine Überprüfung des Therapieerfolges findet mindestens vier Wochen nach Ende der Antibiotika-Einnahme statt. Routinemäßige Verlaufskontrollen zum Ausschluss einer H. pylori-Reinfektion werden nicht empfohlen.
Helicobacter pylori Gastritis: Eradikation mit Bismuth (Pylera).
Eradikationsschema Helicobacter
Erstlinienbehandlung:
- Clarithromycin 2x500 mg/Tag, Amoxicillin 2x1000 mg/Tag, PPI für 14 Tage
- Pylera 140 mg/125 mg/125 mg Hartkapseln 4x3 Kapseln/Tag (postprandial), PPI 2x40mg Pantoprazoläquivalente für 10 Tage: Bitte halten Sie einen zeitlichen Abstand von mindestens 3 Stunden zwischen dem Genuss von calciumhaltigen Nahrungsmitteln (zum Beispiel Milch, Joghurt, Quark, Käse, calciumhaltiges Trinkwasser) und der Einnahme des Arzneimittels ein.
Erstlinienbehandlung bei Penicillinallergie:
- Clarithromycin 2x500 mg/d, Metronidazole 2x500 mg/d, PPI für 14 Tage
- Pylera 140 mg/125 mg/125 mg Hartkapseln 4x3 Kapseln/Tag (postprandial), PPI 2x40mg Pantoprazoläquivalente für 10 Tage: Bitte halten Sie einen zeitlichen Abstand von mindestens 3 Stunden zwischen dem Genuss von calciumhaltigen Nahrungsmitteln (zum Beispiel Milch, Joghurt, Quark, Käse, calciumhaltiges Trinkwasser) und der Einnahme des Arzneimittels ein.
Zweitlinienbehandlung:
- Pylera 140 mg/125 mg/125 mg Hartkapseln 4x3 Kapseln/Tag (postprandial), PPI 2x40mg Pantoprazoläquivalente für 10 Tage: Bitte halten Sie einen zeitlichen Abstand von mindestens 3 Stunden zwischen dem Genuss von calciumhaltigen Nahrungsmitteln (zum Beispiel Milch, Joghurt, Quark, Käse, calciumhaltiges Trinkwasser) und der Einnahme des Arzneimittels ein.
- Levofloxacin 2x500 mg/Tag, Amoxicillin 2x1000 mg/Tag für 14 Tage
Drittlinienbehandlung:
Die Drittlinienbehandlung muss anhand eines vorgängig angefertigten Antibiogramms individuell geplant werden.
Wie erfolgt eine Therapiekontrolle (Eradikationserfolgsdokumentation) nach HP-Infektion?
Die Eradikationserfolgskontrolle nach einer Helicobacter pylori-Behandlung bezieht sich auf die Überprüfung, ob die durchgeführte Therapie erfolgreich war und der Helicobacter pylori (H. pylori) Bakterienstamm vollständig aus dem Magen-Darm-Trakt des Patienten eliminiert wurde. Dies geschieht durch eine spezielle Untersuchung etwa 4 Wochen nach Abschluss der Antibiotikabehanlung. In der Regel verwendet man einen Stuhlprobe (Hp-Stuhltest), bei der nach Überresten von H. pylori gesucht wird. Die Eradikationserfolgskontrolle dient mehreren Zwecken:
Sicherstellung der Wirksamkeit der Behandlung: Die Überprüfung stellt sicher, dass die angewendete Therapie die gewünschten Ergebnisse erzielt hat und die Bakterien effektiv eliminiert wurden.
Vermeidung von Rückfällen: Ein erfolgreicher Eradikationserfolg minimiert das Risiko von Rückfällen und erneuten Infektionen mit H. pylori, was wichtig ist, um langfristige Gesundheitsprobleme zu verhindern.
Verhinderung von Antibiotika-Resistenzen: Die Kontrolle hilft sicherzustellen, dass die eingesetzten Antibiotika noch wirksam sind. Eine unvollständige Behandlung könnte zu Antibiotika-Resistenzen führen, was die zukünftige Behandlung erschweren könnte.
Es ist wichtig, die Anweisungen des Arztes genau zu befolgen und die vorgeschriebene Eradikationserfolgskontrolle durchzuführen, um sicherzustellen, dass die H. pylori-Infektion erfolgreich behandelt wurde und um eventuelle Komplikationen zu verhindern.
Was sind Komplikationen einer Helicobacter pylori-Infektion?
Mögliche Komplikationen und Folgeerkrankungen einer H. pylori-Infektion sind:
- Gastroduodenale UlkuskrankheitAdenokarzinom des MagensMALT-Lymphom
Wie ist die Prognose einer Helicobacter pylori-Infektion?
Die H. pylori-Infektion führt in jedem Fall zu einer chronischen Gastritis. Ungefähr 10% der infizierten Personen entwickeln Ulzera, während bei etwa 1% die Erkrankung unbehandelt zu einem Magenkarzinom fortschreitet. Eine Reinfektion nach erfolgreicher Eradikation ist selten und liegt in Industrieländern bei 2% der Fälle pro Jahr, während es in Entwicklungsländern 6-12% sind.
Was kann eine Prophylaxe vor Helicobacter pylori-Infektion darstellen?
Bei allen Personen mit erhöhtem Magenkarzinomrisiko wird empfohlen, ab einem Alter von 40 Jahren eine endoskopisch-bioptische Testung auf H. pylori durchzuführen und bei einem positiven Ergebnis eine Eradikationstherapie zu starten. Diese trägt neben der Magenkarzinomprävention zur Prävention weiterer gastroduodenaler Erkrankungen bei.